上海第二类医疗器械注册审评时间(2021年10月)——以医护人员防护用品为例
医疗器械的注册审评时间是行业内企业和研发机构高度关注的关键环节,它直接关系到产品的上市进度和市场布局。以上海市为例,其作为中国医疗器械产业的重要高地,对第二类医疗器械的注册审评管理具有示范意义。本文将以2021年10月为时间参考点,结合当时政策环境,重点探讨医护人员防护用品这类产品的注册审评周期及相关要点。
一、 2021年10月上海第二类医疗器械注册审评总体时限背景
根据国家药品监督管理局(NMPA)的统一要求,第二类医疗器械的技术审评法定时限为60个工作日(自受理之日起)。2021年,上海市药品监督管理局(SHFDA)持续推进审评审批制度改革,优化流程,力图在法定时限内高效完成审评。对于技术资料清晰、临床评价路径明确、风险可控的产品,审评周期通常较为稳定。但具体时长会受到产品复杂性、资料完整性、是否需要专家审评或补充资料等多种因素影响。
二、 医护人员防护用品的分类与审评特点
医护人员防护用品,如医用防护口罩、医用外科口罩、防护服、隔离衣、医用隔离面罩/眼罩等,在《医疗器械分类目录》中多归属于“14注输、护理和防护器械”大类下的“医护人员防护用品”子目录。在2021年,尤其是后疫情时代,这类产品因其重要的公共卫生意义,审评审批工作备受重视。
其审评特点包括:
- 风险关注点集中:审评重点关注产品的过滤效率(对于口罩)、液体阻隔性能(对于防护服、隔离衣)、生物相容性、微生物指标等核心安全有效性指标。
- 标准体系相对完善:相关国家标准(GB)和行业标准(YY,如GB 19083-2010, YY 0469-2011, GB 19082-2009等)较为明确,为企业准备资料和审评机构进行判断提供了清晰依据。
- 临床评价路径:多数医护人员防护用品可通过同品种比对路径进行临床评价,无需开展临床试验,这在一定程度上缩短了整体注册准备时间,但对比资料的充分性和合规性是审评关键。
三、 影响审评时间的具体因素(以2021年10月为参照)
尽管有法定时限,但从受理到最终获批的实际周期可能会因以下因素波动:
- 资料质量:这是最关键的因素。申报资料(包括产品技术要求、研究资料、检验报告、临床评价资料、生产制造信息等)是否完整、规范、数据翔实,直接决定了审评员进行技术审评的效率。一次提交即符合要求,是保证在60个工作日内完成审评的基础。
- 补充资料环节:若在审评过程中发现需要企业补充资料或说明,审评计时将中止。企业补充资料的时间不计入审评时限,但会拉长整个注册周期。2021年,上海局也在推行“一次性补正”等沟通机制,以提高补正效率。
- 产品创新性与复杂性:虽然防护用品多为成熟产品,但若涉及新材料、新工艺或声称具有特殊功能(如抗病毒、可重复使用等),可能需要更深入的审评和验证,或启动专家咨询,时间可能延长。
- 检验与体系核查:产品检验(注册检验)和质量管理体系核查是注册的前置或并行环节。在2021年,这些环节的衔接顺畅度也会影响整体时间表。
- 行政流程与沟通效率:与审评部门的有效沟通、对于审评意见的及时响应,都影响着进程。
四、 与建议
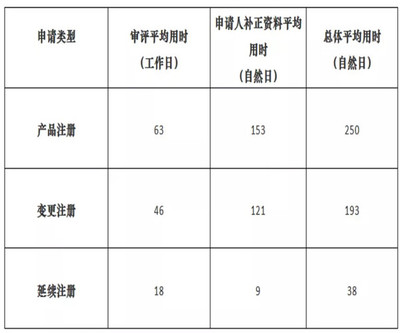
回顾2021年10月的时间节点,对于计划在上海申报第二类医护人员防护用品的企业而言,一个相对顺利的注册审评周期(从受理到获批)目标可设定在4-7个月左右(此时间为整体周期估算,其中技术审评法定时限为60个工作日)。这建立在资料高质量准备、检验提前完成、体系核查顺利的前提下。
给相关企业的核心建议是:
- 深入研究法规与标准:精准把握《医疗器械注册管理办法》、《医疗器械临床评价技术指导原则》以及产品对应的具体国家标准和行业标准。
- 注重注册资料质量:将“一次性通过”作为资料准备的目标,确保所有研究数据真实、完整、可追溯,临床评价路径选择正确、比对证据充分。
- 提前规划与全程管理:将产品检验、体系核查、资料撰写与提交进行一体化规划,留出充足的准备和沟通时间。
- 关注政策动态:医疗器械法规政策处于持续优化中,即使回顾2021年的情况,也应关注后续政策的调整,以便更好地规划当前及未来的注册工作。
总而言之,2021年10月,上海对第二类医疗器械(包括医护人员防护用品)的注册审评工作在法定框架内力求高效。企业通过提升自身注册申报的专业性和规范性,是确保产品顺利、快速上市的最可靠途径。
如若转载,请注明出处:http://www.chinaskinhospital.com/product/54.html
更新时间:2026-02-27 21:04:21