进口医疗器械与医护人员防护用品注册备案全流程详解

随着我国医疗市场的不断开放和医疗服务水平的提升,越来越多的进口医疗器械和医护人员防护用品进入中国市场。为确保这些产品在中国境内使用的安全性和有效性,并符合国家相关法律法规要求,所有进口医疗器械和特定的医护人员防护用品(通常属于医疗器械范畴)都必须经过国家药品监督管理局(NMPA,原CFDA)的注册或备案流程。本文将为您详细解读这一关键流程。
一、 核心概念界定与监管分类
需要明确两个核心概念:
- 医疗器械:根据《医疗器械监督管理条例》,是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件。其效用主要通过物理等方式获得。
- 注册与备案:这是两种不同的市场准入方式。
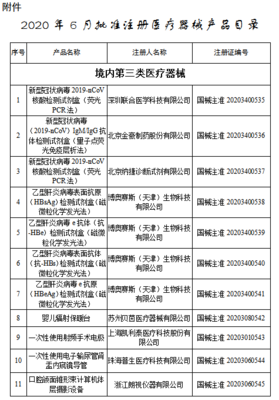
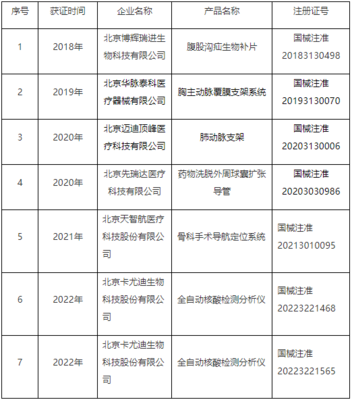
- 注册:适用于风险较高的第二类、第三类医疗器械。需要进行临床试验(部分情形可豁免)、技术审评、体系核查等严格审查,以获得《医疗器械注册证》。
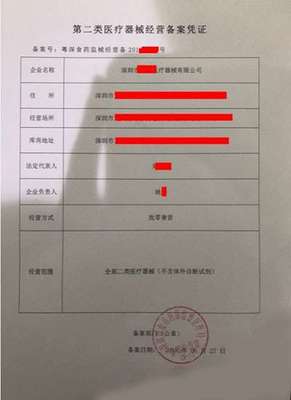
- 备案:适用于风险较低的第一类医疗器械。备案人只需提交备案资料,药品监督管理部门对提交的资料进行形式审查,存档备查,发放《第一类医疗器械备案凭证》。
医护人员防护用品,如医用防护口罩、医用防护服、手术衣、隔离衣、无菌手套等,根据其预期用途和风险等级,绝大部分被划分为第二类(如大多数外科口罩、手术衣)或第三类医疗器械(如用于高风险操作的医用防护口罩、防护服)。因此,它们通常需要履行注册程序,而非简单的备案。
二、 进口医疗器械注册备案全流程解析
以下流程以风险较高的第二、三类医疗器械注册为主干,第一类备案流程相对简化,包含在相应环节中。
第一阶段:前期准备与产品判定(约1-3个月)
1. 指定中国代理人:境外申请人必须指定中国境内的企业法人作为其代理人,履行相关法律义务,如申请注册、承担连带责任、协助召回等。
2. 产品分类判定:根据《医疗器械分类目录》,明确申请产品的管理类别(Ⅰ、Ⅱ、Ⅲ类)。这是决定后续路径的关键。
3. 检测路径规划:确定产品是否需要在中国境内进行检测,以及是否可利用境外临床试验数据或进行临床试验。
第二阶段:检测与临床评价(时间差异巨大,数月到数年不等)
1. 产品检测:通常需要在NMPA认可的境内医疗器械检测机构进行全性能注册检验,取得合格的检测报告。这是注册申报的基石。
2. 临床评价:
* 对于列入《免于临床评价医疗器械目录》的产品,可免于进行临床评价。
- 其余产品需通过临床试验或同品种比对的路径完成临床评价。临床试验需在具备资质的医院进行,并获得伦理委员会批准,周期长、成本高。同品种比对需详尽证明产品与已上市同类产品在安全有效性上等同。
第三阶段:注册申报与审评审批(Ⅱ类约1-2年,Ⅲ类约2-4年)
1. 体系核查:NMPA可能对境外生产场地进行质量管理体系现场核查,或委托当地监管机构核查。
2. 提交注册申请:通过NMPA医疗器械注册电子申报系统(eRPS)提交全套技术资料,包括研究资料、检测报告、临床评价资料、生产制造信息、产品说明书和标签样稿等。
3. 技术审评:审评中心对资料进行科学审核,可能发出补充资料通知。此阶段是核心,需要与审评机构密切沟通。
4. 行政审批与发证:技术审评通过后,进入行政审批环节,最终作出准予注册或不予注册的决定。准予注册的,颁发《医疗器械注册证》。
第四阶段:备案(针对第一类医疗器械)
流程大幅简化:准备备案资料(包括产品检验报告、说明书等)→ 通过eRPS系统提交 → 所在地省级药监局形式审核 → 符合要求的,予以备案并公示,发放备案凭证。
三、 医护人员防护用品注册的特殊关注点
- 应急审批与优先通道:在公共卫生事件应急状态下(如新冠疫情),对于急需的防护用品,NMPA设有应急审批程序,极大压缩审评时间。但疫情常态化后,新产品的注册仍需走标准流程。
- 标准符合性:产品必须符合强制性国家标准(GB)或行业标准(YY),例如GB 19083-2010《医用防护口罩技术要求》、GB 19082-2009《医用一次性防护服技术要求》。境外标准(如ASTM, EN)需进行比对,证明其等效性或更优性。
- 生物相容性与微生物指标:与皮肤、黏膜接触的防护用品(如手套、口罩内层)需提供详尽的生物相容性评价报告。无菌产品需严格验证灭菌工艺和无菌保证水平。
- 标签与说明书:必须具有完整的中文标签和说明书,内容需符合中国法规要求,包括产品名称、型号规格、生产企业信息、中国代理人信息、注册证编号、生产日期、使用说明、禁忌症等。
四、 常见挑战与建议
- 挑战:法规理解差异、临床评价要求高、检测周期长、审评沟通成本高、体系核查跨国协调难。
- 建议:
- 尽早介入:在产品研发早期即引入中国法规要求。
- 依靠专业伙伴:选择经验丰富、靠谱的中国代理人和国内法规咨询服务团队。
- 确保质量体系合规:确保境外生产质量体系符合中国《医疗器械生产质量管理规范》要求。
- 主动沟通:与检测机构、审评中心保持积极、专业的沟通。
###
进口医疗器械及医护人员防护用品的注册备案是一个严谨、复杂且耗时的系统工程,涉及技术、法规和管理的深度融合。全面理解流程、充分准备资料、严格遵守法规,并与专业机构紧密合作,是成功获得中国市场准入许可、保障产品合法合规销售与使用的关键。随着中国医疗器械法规的持续完善与国际接轨,这一过程正朝着更加科学、透明和高效的方向发展。
如若转载,请注明出处:http://www.chinaskinhospital.com/product/49.html
更新时间:2026-02-27 04:13:14